Le mot addiction indique dans son sens originel une soumission à une volonté autre qui nous commande, une sujétion, c’est l’étymologie d’ad-dictus. Aussi la diffusion de drogues addictives dans les sociétés orientées par des valeurs d’autonomie est-elle éminemment troublante. Cette sujétion entre en contradiction avec les normes sociales et morales prévalentes des sociétés modernes individualisées, elle ne se présentait pas de cette manière dans les sociétés anciennes. Les politiques publiques, ciblant d’abord les produits par l’interdit et les comportements par des sanctions pénales, se sont orientées depuis quelques décennies vers une médicalisation croissante. La vision de l’abus de drogue comme maladie substitue à ce qui était autrefois présenté comme une figure du mal un mal-être[1], cependant elle ne prive pas le toxicomane d’un rôle actif. Nous oscillons entre deux attitudes qui définissent les polarités contraires de l’idéal humaniste : la tendance à nous imputer ce qui nous arrive, comme l’expression d’une volonté libre, en tous cas capable de surmonter des forces de l’instinct et du milieu, et la tendance à voir dans le milieu interne et externe une force capable de soumettre notre volonté. Les abus de drogues poussent cette tension à un point extrême où le sujet disparait quasiment. Voir des individus se droguer parfois jusqu’à en mourir, sans que personne ne les y oblige est difficile à comprendre et à accepter. Aussi attend-on que les neurologues et les psychiatres nous disent comment ce rapt de la volonté, cette destruction de l’identité parvient à s’opérer sans contrainte externe.
Il est maintenant admis que la particularité de l’effet des drogues chimiques chez l’homme n’est pas la puissance du plaisir qu’elles donnent mais la subjugation qu’elles suscitent.
1-Je soutiens que l’abus de drogue, s’il n’exonère certes pas totalement notre responsabilité, est une conduite où l’on réagit à des pressions plus internes qu’externes ; que cet abus est parent des troubles anxiodépressifs. L’abus de drogues, notamment stimulantes, remplit, dans les sociétés occidentales, une fonction de compensation du déficit de plaisir.
2- Je soutiens que le basculement social des abus de drogue parmi les couches dominées est l’expression, quelque peu paradoxale, de l’émancipation de la rareté, et doit beaucoup à la perte des solidarités typiques de la société salariale que nous avons connue.
I Les limites de la récompense
Il faut entrer dans le mécanisme pour saisir cette dérive spécifiquement humaine par rapport à ce que dicte l’instinct. Les paquets de neurones qui irriguent les aires du cerveau et les neuromédiateurs qui y circulent sont les vecteurs des sensations et des émotions. Les aires sous-corticales sont les substrats où se comparent les valeurs accordées aux émotions dans un échange à double sens avec les zones corticales. Les drogues addictives abaissent le seuil de la récompense, qui se trouve globalement plus élevé chez ceux qui sont attirés par les drogues qu’en moyenne. Cet abaissement du seuil sous l’effet de la drogue paraît surprenant quand on songe à l’accoutumance. Il n’intervient qu’avec le temps : pour un même individu, l’accoutumance au produit s’élève à mesure qu’il réitère sa consommation, de sorte qu’il lui faut effectivement une excitation plus forte, une dose plus élevée, pour avoir du plaisir.
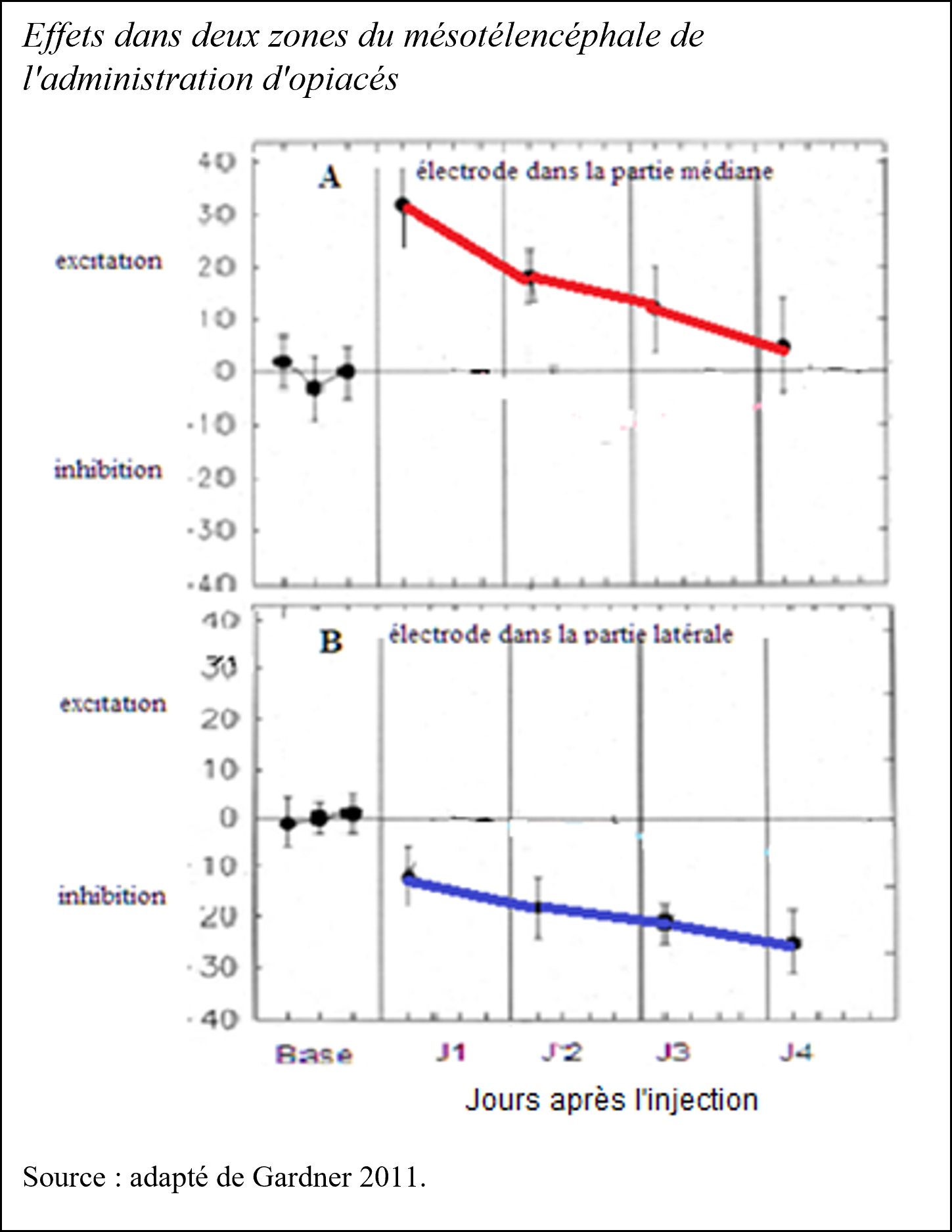
Les opiacés en se diffusant dans le cerveau induisent des sensations distinctes selon les zones. Dans la partie médiane du tractus méso-télencéphalique, les fibres dopaminergiques enregistrent des stimulations agréables, une augmentation de la récompense cérébrale, mais cet effet s’atténue jour après jour, à mesure qu’une tolérance se développe (figure A). Dans la partie latérale du tractus méso-télencéphalique[2], cette administration élève le désagrément ressenti. Celui-ci augmente d’un jour à l’autre : il y a croissance de l’inhibition, c’est-à-dire du déplaisir avec les administrations successives (figure B)[3]. La tonalité hédonique globale due aux drogues addictives est une combinaison des effets décrits en A et B, ce n’est pas une addition, car les voies ne sont pas identiques. Avec la chronicité des injections, les effets de récompense diminuent et parallèlement des effets dysphoriques s’intensifient. La présence simultanée des deux effets n’est pas un plaisir atténué, si l’on veut une analogie, c’est ce que l’on éprouve en écoutant un concert avec un début de rage de dents.
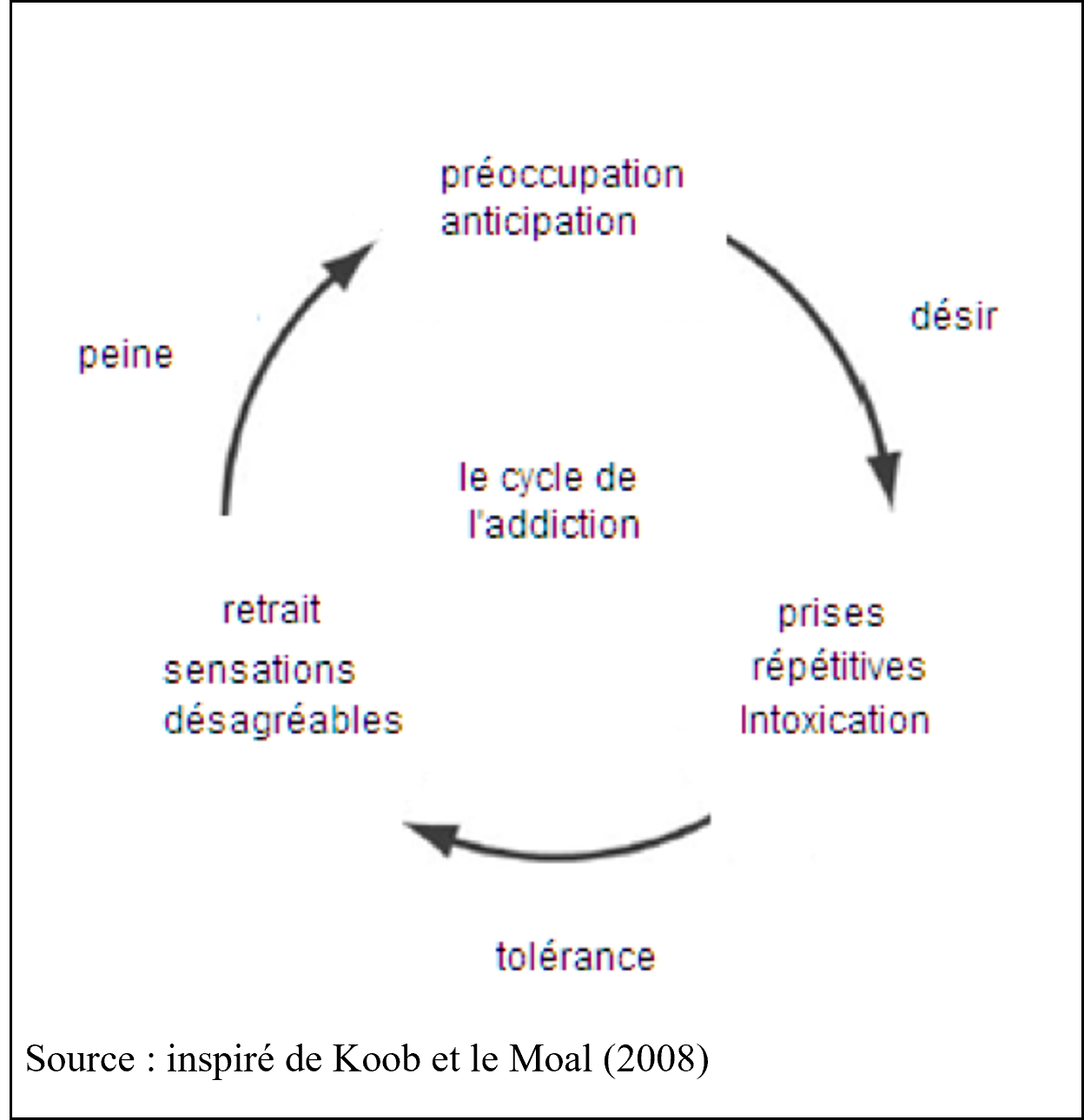 De l’impulsivité à la compulsivité, la consommation de drogue parcourt, selon Koob et Le Moal, « un cycle en trois étapes : frénésie/intoxication, retrait/affect négatif et préoccupation/anticipation. » Á mesure que les individus cheminent de l’impulsif au compulsif, la motivation pour la consommation de drogue passe d’un renforcement positif à un renforcement négatif. Les circuits qui dominent dans la phase d’addiction et de dépendance diffèrent. « Le premier impliquant des réponses hédoniques …, se produit peu après la présentation de la drogue, il est étroitement lié à l’intensité, à la qualité et à la durée [d’action du produit] et traduit de la tolérance[4]. » Dans cette phase initiale la motivation à ingérer la drogue est renforcée – les souris vont vers le lieu où elles ont éprouvé du plaisir. « Le second processus apparaît à la fin du premier. Il est lent à se mettre en place… lent à se stabiliser, et s’amplifie avec une exposition répétée. » La phase de plaisir se prolonge au cours de ce même cycle par un processus aversif. La dérive pathologique dans l’addiction est un processus continu où interagissent la nature des drogues consommées, la fréquence et les modes de consommation, le développement du syndrome de tolérance et de retrait. L’addiction et le retrait forment un cycle dont les phases s’enchaînent, la phase d’accrochage implique notamment l’aire ventrale tegmentale, tandis que la phase de retrait, aversive implique la zone périventriculaire (ou latérale).
De l’impulsivité à la compulsivité, la consommation de drogue parcourt, selon Koob et Le Moal, « un cycle en trois étapes : frénésie/intoxication, retrait/affect négatif et préoccupation/anticipation. » Á mesure que les individus cheminent de l’impulsif au compulsif, la motivation pour la consommation de drogue passe d’un renforcement positif à un renforcement négatif. Les circuits qui dominent dans la phase d’addiction et de dépendance diffèrent. « Le premier impliquant des réponses hédoniques …, se produit peu après la présentation de la drogue, il est étroitement lié à l’intensité, à la qualité et à la durée [d’action du produit] et traduit de la tolérance[4]. » Dans cette phase initiale la motivation à ingérer la drogue est renforcée – les souris vont vers le lieu où elles ont éprouvé du plaisir. « Le second processus apparaît à la fin du premier. Il est lent à se mettre en place… lent à se stabiliser, et s’amplifie avec une exposition répétée. » La phase de plaisir se prolonge au cours de ce même cycle par un processus aversif. La dérive pathologique dans l’addiction est un processus continu où interagissent la nature des drogues consommées, la fréquence et les modes de consommation, le développement du syndrome de tolérance et de retrait. L’addiction et le retrait forment un cycle dont les phases s’enchaînent, la phase d’accrochage implique notamment l’aire ventrale tegmentale, tandis que la phase de retrait, aversive implique la zone périventriculaire (ou latérale).
Les manifestations du manque chez le toxicomane ne sont pas analogues à la dépendance du diabétique car, dans la phase de retrait, il y a un renforcement négatif, un rejet psychique de la drogue. Le système nerveux central, qui est parvenu à modérer l’intensité des réactions pendant quelque temps, échoue à réguler la conduite. Koob et Le Moal ont illustré empiriquement ces oscillations sans point d’équilibre, résultant de la conjugaison de motivations de sens opposés qui régit les comportements chaotiques du toxicomane[5]. Il est remarquable que pendant la phase de chronicisation de l’abus de drogues s’opère une dérégulation de l’axe hypothalamus-hypophyse-surrénales, il y a une sollicitation des hormones du stress analogue à celui qui intervient face au danger physique[6].
On sait depuis les expériences réalisée par Bozarth et Wise en 1982 que les rats s’administrent volontiers des opiacés dans le circuit de la récompense, l’aire tegmentale ventrale, sans que cette administration n’entraîne de dépendance physique, qu’inversement, des injections d’opiacés dans des aires postérieures du tronc cérébral (le noyau dorsal du raphé) entraînent une dépendance physique et des symptômes de sevrage. Mais comme le souligne Eliott Gardner (2011), les rats ne s’auto-administrent pas d’opiacés dans cet endroit. La puissance de l’imagination rend les drogues addictives redoutables pour l’homme.
Bien que l’efflux dopaminergique mésolimbique associé à la récompense médicamenteuse ait été précédemment considéré comme l’équivalent biologique du plaisir, il s’avère que l’activation dopaminergique se produit également en présence de stimuli inattendus et nouveaux (soit agréables, soit aversifs) et détermine un état motivationnel de désir ou d’attente. Les sensations immédiates d’euphorie sont encodées par l’hippocampe, le lieu de la mémoire, de sorte que ce plaisir éprouvé est entouré d’indices, notamment le contexte de l’accès à la drogue, les personnes avec lesquelles on en a pris. Avec la répétition de l’expérience s’établit un conditionnement pavlovien, les scènes rappelant l’épisode de prise de drogue suscitent une anticipation du plaisir de la drogue. Progressivement, la seule évocation de ces contextes induit dans le cerveau des flux de dopamine et accessoirement de sérotonine. Par conditionnement, un stimulus sans effet physiologique – la vue d’une scène de drogue – acquiert la capacité d’augmenter le flux de dopamine[7]. On pourrait penser que lorsque l’arrivée de la drogue ne suit pas, l’annonce, devenue trompeuse, perd sa force. Ce n’est pas le cas. Le renforcement de la consommation de psychotropes par le flux de dopamine est plus complexe que le simple codage de la récompense par le signal. La force motivante du stimulus conditionné est définie par le niveau anticipé de la récompense[8]. Le flux de dopamine ne s’accroit pas seulement en réponse au plaisir mais aussi, voire surtout, en regard de l’anticipation du plaisr, y compris dans un état aversif. L’aversion n’empêche pas la quête de drogue, parce que l’image de la scène de drogue prend en quelque sorte le pas sur le plaisir. Cette anticipation détermine un désir de drogue (wanting), qu’on doit distinguer d’un plaisir à la drogue (liking).
Á partir de là, les produits et les susceptibilités diffèrent. Les drogues induisent des processus d’addiction/intoxication et de retrait/aversion d’une intensité variable : la nicotine, les amphétamines et la cocaïne sont très addictifs mais induisent moins d’aversion que l’alcool, les opiacés et les barbituriques. Le syndrome de retrait/aversion trouve son expression la plus nette avec les opiacés[9]. L’opiomane qui a un usage chronique doit maintenir cet usage sous peine de souffrir d’une manière peu tolérable ; ce n’est ni la pression des pairs, ni la vue du produit qui induit cette souffrance inscrite dans le corps et, s’il n’est peut-être pas plus facile d’arrêter de fumer, le désagrément ressenti est moindre. La motivation de l’héroïnomane à se tourner vers le produit alors qu’il souffre est d’abord neurophysiologique, pour l’addict à la cocaïne, l’envie de recommencer est plus psychologique en raison de l’intensité du flux de dopamine induit.
Par ailleurs, certains individus sont plus que d’autres inclinés par leurs dispositions. De nombreuses données biogénétiques obtenues sur des échantillons très contrastés, ainsi que des méta-analyses et des échantillons des bio-banques du Royaume-Uni révèlent de multiples localisations génétiques communes au risque de dépendance à divers psychotropes. Les usages problématiques (abusifs) des substances psychotropes ont une signature génétique différente de l’usage[10]. Dès lors, « émerge de ces travaux la nécessité de distinguer sur le plan biogénétique entre [l’usage] de substances – qui peut impliquer niveaux de consommation faibles et sans dépendance – et les usages problématiques, écrivent Gelernter & Polimanti (2021) »
Corrélations génétiques entre la consommation problématique d’alcool, de cannabis, de cocaïne, d’opioïdes et de nicotine, et les troubles psychiatriques
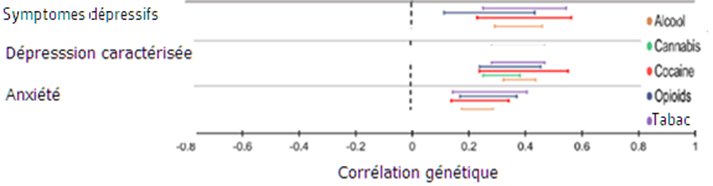
Source : adapté de Gelernter & Polimanti, 2021. Les corrélations dont la valeurs sont représentées par le centre des barres de couleur, portent sur le marquage génétique commun aux troubles psychiatriques et aux abus de drogues.
La comparaison des signatures génétiques des abus de drogues et des troubles psychiatriques, réalisée par scannage du génome, montre qu’il y a, là aussi, un marquage génétique commun, c’est-à-dire que les mêmes gènes sont impliqués chez les individus qui présentent un usage problématique à divers psychotropes et chez ceux qui présentent des troubles psychiatriques (représentés à gauche sur le graphique ci-dessus). Si l’on se limite à des usages occasionnels, on ne trouve pas de telles corrélations. L’approche neurogénétique pointe ainsi l’importance des effets génétiques liant les abus de drogues et les troubles psychiatriques contemporains les plus répandus.
II La toxicomanie internalise une domination sociale
Une posture humaniste a conduit à faire l’hypothèse que les comportements addictifs pourraient être contrôlés par un mélange de prévention et de soins, cela s’est avéré insuffisant. Ce point de vue a priori généreux pour l’homme n’a pas eu les effets escomptés. Je soutiens que les drogues addictives sont devenues un pansement, une compensation externalisée d’une domination sociale, comme la dépression est une compensation internalisée. Je ne dis pas que la domination sociale suffit à déterminer les abus de drogue mais contribue à expliquer l’ampleur des pratiques qui relèvent de l’addiction dans les pays développés.
J’en veux d’abord pour preuve le fait que ces produits répondent aujourd’hui à des déséquilibres psychophysiologiques plus répandus parmi les groupes infériorisés, stigmatisés, en manque de reconnaissance sociale. Comme l’indiquent les données empiriques ces groupes sociaux sont aujourd’hui plus souvent dans le cas d’avoir des conduites d’abus que les membres des groupes sociaux plus aisés. L’histoire de la toxicomanie – cannabis, opioïdes et plus encore drogues stimulantes – indique qu’au 19e siècle et au premier 20e siècle l’usage de ces substances était le fait de milieux artistiques, d’intellectuels et de bourgeois marginaux, il a ensuite investi largement les classes moyennes scolarisées, puis s’est diffusé dans les strates populaires par les rassemblements festifs et des goûts musicaux partagés. Les données sociologiques récentes indiquent une inversion du gradient social dans l’abus des psychostimulants. Il intervient au cours des années 2000 en Amérique du Nord, et au Royaume-Uni, un peu plus tard dans la majorité des pays d’Europe dont la France. Les enquêtes de l’Office Français des Drogues et Tendances addictives retracent une baisse des consommations d’alcool de 1995 à la veille de la crise sanitaire de 2008 qui s’opère parallèlement chez les jeunes de tous milieux. Le tabagisme s’est aussi tassé, fumer tous les jours n’est plus le fait que de 5 % des jeunes en 2017 contre 12 % en 2002, et la différence selon les milieux est ténue. Si l’évolution du cannabis depuis un quart de siècle est plus sinueuse, si à la fin du 20è siècle cette pratique, héritière des tendances antiautoritaires des années 1960, est encore fréquente chez les jeunes des milieux favorisés, de 2002 à 2017, l’usage régulier de cannabis[11] tombe à 6 % chez les jeunes des milieux favorisés, tandis que chez les apprentis la proportion d’usagers réguliers se stabilise à un niveau presque trois fois plus élevé, autour de 15 %. Et, parmi les jeunes en difficulté, à la fois déscolarisés et sans activité professionnelle, elle atteint 21 %. Quant aux psychostimulants, comme la cocaïne, la demande a glissé vers les périphéries urbaines pauvres où l’on fume aussi le crack, dérivé très destructeur souvent acheminé par des réseaux antillais en France. Jadis drogue de ceux qui voulaient « croquer le monde », la cocaïne est aujourd’hui souvent un remède : on trouve deux fois plus d’utilisateurs parmi les chômeurs que parmi les actifs. Un changement de statut social des consommateurs des drogues les plus puissantes s’est opéré au cours des dernières décennies. Il est l’indice d’un changement de fonction des addictions.
L’enjeu est de compenser un mal-être qui n’est pas purement physique mais psychophysique. Les animaux ne se droguent pas spontanément. Si les hommes font ce que les animaux ne font pas, s’ils vont de manière hégélienne à l’encontre de l’instinct qui conduit à arrêter quand on n’éprouve plus de plaisir, c’est que la puissance de l’imagination du plaisir constitue pour eux un motif plus puissant que la peine physique. L’alcoolisation permettait autrefois l’oubli de pénibilité du travail, il pourrait s’agir aujourd’hui d’effacer une mise à l’écart et de s’affranchir du manque de plaisir de la vie au travail dans un contexte marqué par l’affaiblissement des soutiens collectifs. Il s’agit peut-être pour une fraction des individus de s’emparer dans l’imaginaire de ce qui les subjugue chez les stars du spectacle, du sport, de la politique.
Pour ceux que des circonstances de vie et des dispositions défavorables ont conduit à une chronicisation des abus de drogues, l’idée qu’une instance, qu’on l’appelle vouloir ou d’un autre nom, régit nos actes est une fiction. Qui est ce qui veut quand on dit ‘je veux’ ou ‘je ne veux pas’ ? La supposition d’un poste de commandement, d’un siège de la volonté qui aurait le dernier mot n’a guère de sens. Le cerveau se débat avec les sensations intéroceptives que l’on se représente à tort sur le mode d’une querelle des motifs arbitrée par la raison. Il faut penser en termes d’équilibres neuropsychiques polycentriques. N’importe quelle représentation du cerveau montre un écheveau de voies où circulent des impulsions faisant intervenir les expériences passées et les attentes futures qui se mêlent et se contrecarrent. Ce n’est pas intentionnellement que le toxicomane omet les aspects négatifs qui pourraient le dissuader dans sa quête. Il y a dans l’abus de drogue, une tentative désespérée d’agir pour trouver du plaisir. Comme chez les déprimés le contrôle des émotions par le cortex est lâche, ce qui implique aussi une moindre pénétration des zones corticales par les émotions agréables. En cela le toxicomane comme le déprimé questionnent la réussite matérielle et une philosophie de la volonté centrée sur la conscience vigile. À quel prix !
Mots-clés : Cerveau – Drogues – Addiction – Social
Reférences
Gardner E., 2011 Introduction: Addiction and Brain Reward and Anti-Reward Pathways. Adv Psychosom Med. ; 30: 22–60
Gelernter J. & Polimanti R. 2021. Genetics of substance use disorders in the era of big data Nat Rev Genet.; 22(11): 712–729.
Koob G.et le Moal M. 2008. Neurobiological mechanisms for opponent motivational processes in addiction. Phil. Trans. R. Soc. B ; , 3113–3123
Koob G. 2011 Neurobiology of addiction. Focus ; Winter 2011, Vol. IX, No. 1
OFDT (2019) Drogues, chiffres clés (8e édition). Paris, OFDT
Schultz W 2006 Behavioral theories and the neurophysiology of reward . Annu. Rev. Psychol. 57:87–115
Spilka S., Le Nézet O., Janssen E., Brissot A., Philippon A. 2021. Vingt ans d’évolutions des usages de drogues en Europe à l’adolescence. Tendances, OFDT, n° 143
[1] On entend le traiter par des molécules chimiques plutôt que par des exorcismes. Si l’idée d’une possession par le malin nous parait ridicule, est-elle au fond plus grotesque que l’idée– implicite dans nombre de visions laïques – d’une jouissance masochiste, nécessairement pathologique ?
[2] Substantia nigra, raphé.
[3] La tolérance ou accoutumance désigne le fait qu’injectées dans la partie médiane du télencéphale les mêmes doses de morphine produisent jour après jour un « high » plus faible (A), et dans la partie latérale un désagrément plus fort (B).
[4] Koob et le Moal 2008, ainsi que la citation suivante.
[5] Ces deux auteurs considèrent qu’il n’y a pas lieu d’employer des mots distincts, et préfèrent insister sur le cycle au sein duquel oscille le toxicomane. Cependant en concordance avec les analyses d’auteurs comme Nestler, Volkow, Gardner, ils mettent en évidence des flux de récompense et d’aversion distincts.
[6] « L’amygdale envoie des efférences à la partie médiane du pallidum ventral et vers l’hypothalamus latéral, qui sont précisément les zones cérébrales assurant l’interface entre les structures limbiques [et corticales], précise Koob 2011.» Les hormones du stress mentionnées sont le CRH et l’ACTH.
[7] Dans le nucleus accumbens – une zone du striatum.
[8] Des découvertes importantes ont été faites par Schultz (1998), établissant l’existence d’un comportement spécifique lié à l’anticipation des récompenses. Il a montré que la réception d’une récompense imprévue était associée à une augmentation du taux d’excitation des neurones dopaminergiques dans le mésencéphale et le striatum, ce qui entraîne une augmentation de la libération phasique de dopamine dans ces régions. En revanche, lorsque la récompense attendue est absente, l’excitation des neurones dopaminergiques est supprimée.
[9] Toutefois, contrairement à une idée répandue, le traitement médical approprié de la douleur par les opiacés n’entraîne pas de risque d’accoutumance chez la grande majorité des patients douloureux. Premièrement, la douleur chronique inhibe le comportement de recherche d’opiacés dans les modèles animaux. Deuxièmement, la douleur chronique inhibe la dopamine stimulée par les opiacés dans les circuits neuronaux de récompense et de rechute de l’aire tegmentale ventrale et du noyau accumbens (Gardner 2011).
[10] Du moins tel qu’il est observé avec des substances pour lesquelles il existe suffisamment de données pour effectuer une comparaison (l’alcool et le cannabis notamment), expliquent Gelernter & Polimanti, 2021. Les manuels diagnostiques récents, DSM-IV ou V américain comme la classification internationale CIDI-11, définissent-ils un trouble en ciblant l’incapacité à interrompre l’utilisation, en la distinguant de l’usage.
[11]Dix fois par mois ou plus.
- A quoi sert la toxicomanie ? Retour sur les drogues addictives - 28 septembre 2023
- Infectants & vulnérables : les ambiguïtés du confinement - 7 février 2022
- Le Covid19, les gènes et le comportement* - 9 août 2021

Commentaires récents