La pandémie de Covid19 sévit maintenant depuis près d’un an, on peut s’interroger sur les différences abyssales entre les taux de décès d’un pays à l’autre. Premier constat, l’Afrique a été peu touchée. La première idée qui vient à l’esprit est que l’Afrique a été épargnée en raison même de sa démographie : continent jeune, elle paye un tribut plus léger à un virus qui touche surtout les plus âgés. Les Africains de plus de 70 ans sont peu nombreux. Admettons, mais pour les Asiatiques, l’argument n’est pas convaincant. Les Japonais sont les champions mondiaux de l’espérance de vie et ils n’ont pas connu une forte mortalité associée à la Covid19. C’est un archipel, dira-t-on ! En Chine, où l’espérance de vie a rattrapé celle des États-Unis, la population est aussi épargnée. On objectera que les Chinois vivent sous un régime dictatorial qui a imposé des restrictions inimaginables à l’Ouest. Peut-on retenir cependant l’argument de la coercition comme une raison majeure ? Des pays comme Taïwan, Singapour, la Malaisie, la Thaïlande, le Sri Lanka et la Corée du sud n’ont pas des régimes plus dictatoriaux que la Turquie, la Hongrie, la Pologne ou la Russie, ils connaissent peu de victimes bien que les plus de 65 ans représentent plus de 10 % de la population (contre moins de 2% en Afrique subsaharienne). Comme le remarque Jean-Paul Sardon (2020), la progression avec l’âge du taux des décès dus à la Covid19 est très similaire à la répartition des taux de mortalité par âge avant la pandémie. Cela est vrai sur tous les continents, mais la conséquence en est particulièrement manifeste dans les pays développés où la Covid19, à l’instar de la grande faucheuse, se montre impitoyable avec les plus de 70 ans[1]. Alors, si sa jeunesse a pu protéger l’Afrique, ce ne sont ni la jeunesse ni l’absence totale des libertés démocratiques qui rendent compte de la rareté des décès en Asie, quoique le pouvoir de contraindre ait pu indiscutablement réduire les contaminations.
Géographie des taux de décès
La variance des taux de décès n’est pas la même selon que l’on prend comme référence telle ou telle région du monde, qu’on réunit dans la même analyse plusieurs régions, qu’on découpe les unités spatiales de manière plus ou moins fine. La notion de pays n’est pas forcément la plus légitime, car la taille et l’homogénéité des nations sont variables, mais c’est le lieu de la décision politique et la plus accessible. Une comparaison portant sur la grande majorité des régions du monde, écartant de petites nations (moins de 300 000 habitants), dont beaucoup d’îles de l’Atlantique et du Pacifique, montre que la mortalité due à la Covid19 affecte très inégalement les grandes régions du monde : l’Europe et les Amériques sont beaucoup plus touchées que l’Afrique et surtout l’Asie (carte ci-dessous).
Une autre carte présente avec celle-ci une ressemblance frappante. Elle suggère que le tribut relatif payé à la Covid19 est l’effet de la diffusion d’une autre « pandémie » : l’obésité[2]. Depuis le début de l’épidémie de Covid19, les cliniciens ont indiqué que l’obésité est une condition aggravante, impliquant notamment un recours fréquent à l’assistance respiratoire. On pourrait s’en tenir là et soutenir que le malheur présent des hommes est une pathologie de l’abondance, la sanction de la réussite économique. L’obésité seule rend compte de près de 40% de la variance des décès entre pays. Toutefois on n’explique pas ainsi comment la contamination s’est diffusée. On est alors amené à envisager une interprétation différente, mobilisant le rôle attribué par les immunologistes à la protéine de surface du virus (S), sans exclure l’obésité.
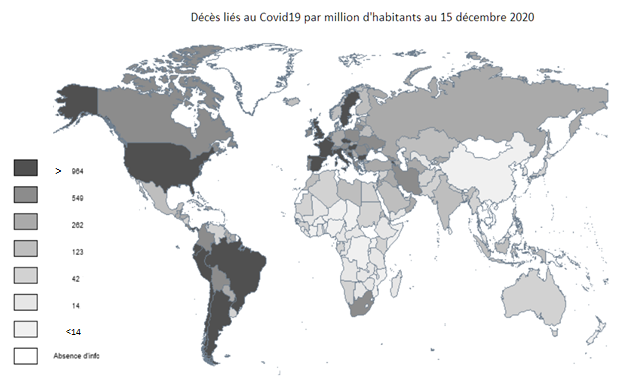
Source : carte de l’auteur avec Philcarto ; données Worldometer 20 décembre 2020
Géographie de l’obésité 2019
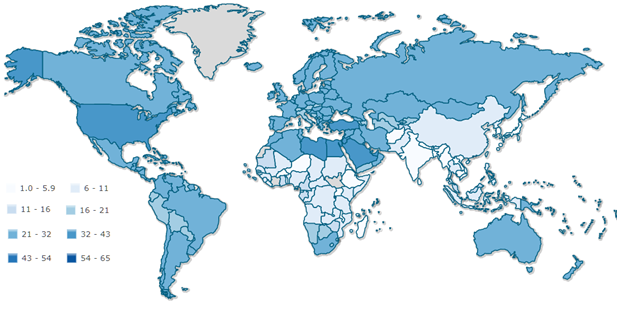
Source : Index mundia
Il peut y avoir beaucoup de décès parce qu’il y a beaucoup de contaminations, ou parce qu’à niveau de contamination donné, la létalité du virus est forte. Cela n’implique pas les mêmes processus sociaux ni les mêmes réponses de l’organisme[3]. Suivant l’interprétation classique proposée par l’épidémiologie, le taux de décès se compose comme un produit : la part des personnes infectées et la proportion de décès conditionnellement au fait d’être infecté. Le SARS-cov2 s’attaque aux fonctions respiratoires, il utilise pour pénétrer l’organisme l’affinité de la protéine en pointe avec le récepteur de l’enzyme ACE2 qui se trouve à la surface de nos cellules notamment pulmonaires[4]. Lorsque cet enzyme est abondamment exprimé, le virus pénètre aisément l’organisme, et plus de contaminations impliquent plus de décès[5]. L’observation des enfants et adolescents qui expriment peu l’enzyme ACE2 dans leurs cellules épithéliales semble corroborer ce fait. En s’arrêtant là on ne comprend pas toutefois l’importance relative des décès.
____________
* Le double II indique que le gène codant pour l’enzyme ACE1 est de la forme double insertion, ce qui se traduit par un niveau faible d’expression de l’enzyme ACE1 circulant (voir Rigat & al. 1990).
**ACE1 et ACE2 sont des enzymes, agissant sur nos fonctionnements face à l’infection. Tandis que les génotypes ACE-II ou ACE-DD sont le code de fabrication des protéines. Ils n’agissent qu’indirectement à travers l’actions des protéines qu’ils ont contribué à produire. Ce résumé s’appuie notamment sur Devaux & al. (2020).
L’enzyme ACE2 joue successivement des rôles opposés : sa présence favorise les infections, mais c’est ensuite sa destruction par le virus qui élève les taux de létalité, c’est-à-dire de transformation des infections en décès. On doit affiner l’équation résumant le mécanisme de propagation de la maladie en dissociant
- un facteur de susceptibilité (incluant l’exposition au virus, et le développement d’une forme symptomatique de la Covid19 sachant que l’on a été exposé),
- un facteur de létalité : mourir (ou développer une forme grave de la maladie)
Cette décomposition est similaire à celle qui détermine le « R0 ».
L’enzyme ACE2, les groupes sanguins et l’obésité
D’où une reformulation. Comment se distribuent les fragilités, la propension à l’hypertension et à l’inflammation ? Il s’agit de déséquilibres qui ne sont pas transmissibles mais se manifestent par le caractère inapproprié, par excès ou par défaut, des réponses adaptatives et sont influencées par des facteurs génétiques. Commençons par là.
Les données sur la distribution géographique des polymorphismes du gène codant pour l’enzyme ACE1, enzyme sœur de ACE2 qui nous intéresse directement, se sont multipliées au cours des quinze dernières années. Pour distinguer les effets des concentration de l’enzyme ACE2, j’ai retenu la fréquence du génotype ACE-II, la mieux documentée. La distribution du génotype ACE-II qui, à travers la densité d’expression de ACE2, régule l’hypertension et les phénomènes inflammatoires varie beaucoup d’une région du monde à l’autre ; elle a une parenté certaine avec celle des décès dus au Covid19[6].
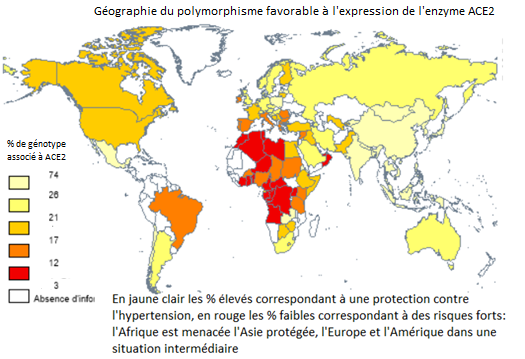
Source : compilation de l’auteur sur la base de nombreuses études.
La létalité du coronavirus dérive, on l’a dit, de la propension à « l’emballement » du système immunitaire, des surréactions et notamment des thromboses, processus complexes influencés par le groupe sanguin. Par rapport au groupe sanguin O, les individus des groupes sanguins A et B ont des risques de thrombose nettement plus élevés. Ce que soulignent Groot & al. (2020), notant cependant des effets divers des groupes sanguins A et B sur les caractéristiques des cellules sanguines. La fréquence du groupe O définit un second facteur génétique à envisager.
Les profils génétiques comme les habitudes de vie ont une certaine homogénéité au sein de chaque continent. Aussi ai-je distingué de grandes régions qui recoupent les cinq continents. Cependant pour l’Afrique subsaharienne, les travaux consultés indiquent que la prévalence du génotype ACE-II diffère sensiblement entre l’Est et l’Ouest, ce qui m’a conduit à en faire deux régions. L’Afrique du Nord est rattachée au pays du Moyen Orient. Voici la distribution des taux de décès, des taux de contamination (mentionnés à titre indicatif) et des valeurs des paramètres génétiques dans les grandes régions distinguées.
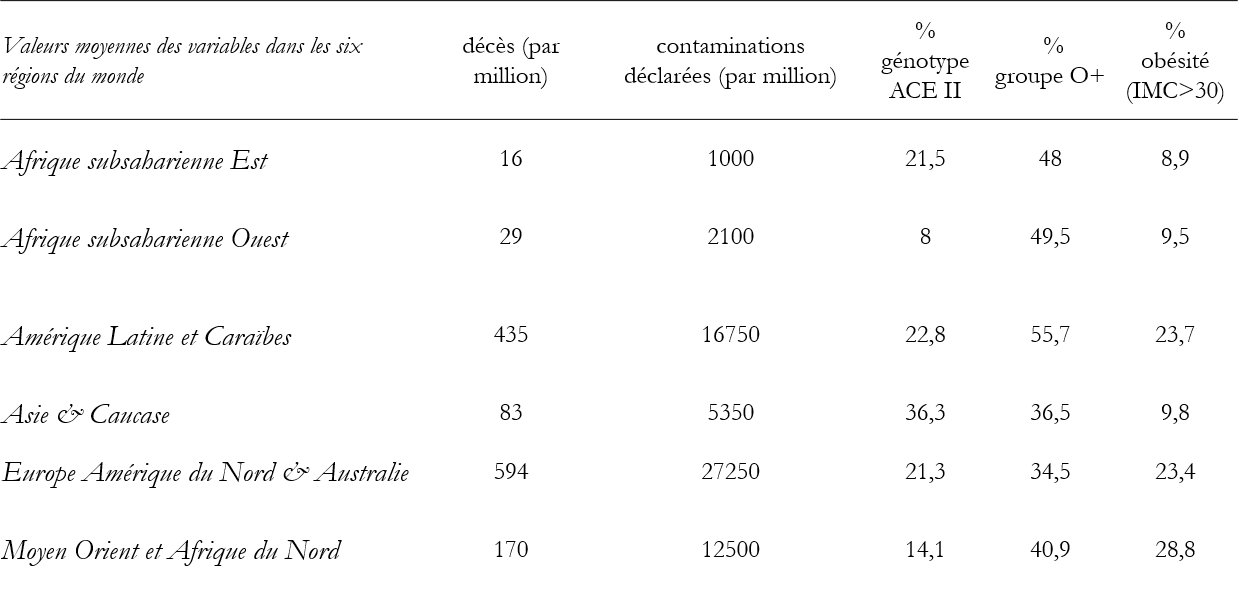
Sources : Worldometer au 15 décembre 2020, Wikipedia, publications des Nations Unies et nombreuses monographies et méta-analyses des polymorphismes génétiques.
Ces facteurs génétiques, ou génétiquement influencés, s’imposent quels que soient les comportements des individus, les systèmes de santé et les politiques publiques en ce domaine. Ils n’épuisent pas l’explication, cependant il nous paraît cohérent avec l’argument développé plus haut de commencer par là. Dans chaque pays, i, le nombre de décès dus à l’épidémie au moment t peut être défini par la relation suivante :
Sachant que le temps moyen qui sépare l’infection du décès éventuel est de 22 jours, il faut introduire un décalage temporel. Le taux de décès dans un pays est le produit des infections cumulées sur la période considérée (décalées de trois semaines) et du taux de létalité (case fatality rate), qui est en principe stable à court terme. L’excès de décès peut encore s’écrire :
Cette expression traduit le fait que le log naturel du nombre cumulé de décès est la somme de deux composantes : le cumul des infections avec un décalage approprié et la gravité de ces atteintes. On peut de plus considérer l’infection et la létalité dans chaque pays comme le produit d’un facteur régional indicé par j, et d’une composante nationale indicée par i, d’où en passant au log[7] :
Les composants des écarts nationaux au taux régional de décès, et
, traduisent des effets sur la létalité et sur les infections dont ne rendent pas compte les facteurs génétiques utilisés. Ainsi, s’ils sont positifs, le surcroît de densité des contacts, les fragilités pathologiques nationales, la structure d’âge de la population du pays ou les limites des politiques menées (confinement, diffusion des masques).
Pour mettre à l’épreuve cette interprétation, ont été utilisés des modèles hiérarchiques distinguant deux niveaux : les grandes régions du monde et, au sein des régions, les pays (sans recourir aux taux d’infection).
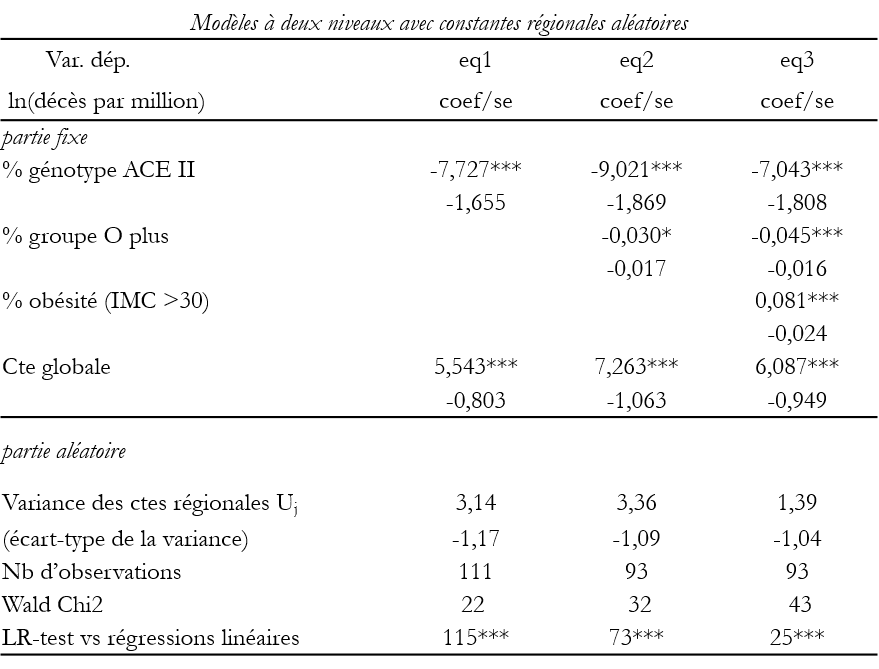
Note: .01 – ***; .05 – **; .1 – *. Du fait des valeurs manquantes concernant les polymorphismes,
et les groupes sanguins, le nombre des pays effectivement utilisés est inférieur à 177 (nb de
pays où l’on dispose des taux de décès).
Les constantes régionales sont des effets aléatoires estimés dont les valeurs dépendent des paramètres génétiques pris en compte. Ainsi pour l’équation 2, les estimations des Uj sont :
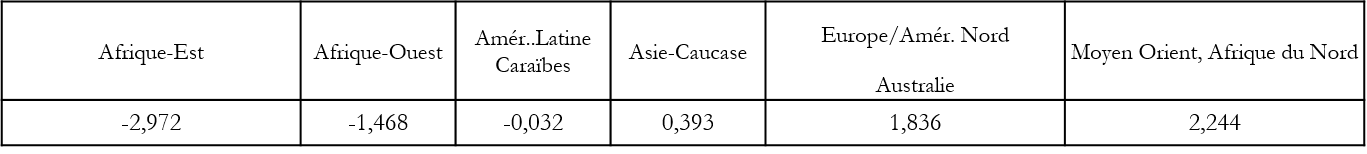
Pour l’Asie Caucase, le taux de décès par million est exp(7,26+0,393) /exp(4,54), tandis que pour l’Europe occidentale & Amérique du nord, le taux estimé est exp(7,26+1,836)/exp(2,95). Le facteur d’atténuation, au dénominateur, dont la valeur dépend des paramètres génétiques, est beaucoup plus favorable à l’Asie.
Une fréquence élevée du génotype ACE-II réduit le taux des décès (coefficients négatifs)[8]. En d’autres termes, les populations porteuses de ce génotype – essentiellement asiatiques – sont moins vulnérables que les Occidentaux et surtout que les Africains chez lesquels il est rare.
De même, là où elle est forte, la prévalence du groupe sanguin O+ diminue significativement le risque de mortalité. En Amérique Latine et dans une moindre mesure en Afrique, elle protège ; sa rareté en Europe et en Asie contribue à y augmenter la vulnérabilité des populations.
En revanche, une forte prévalence de l’obésité, ou des gènes associés, tend à élever la mortalité. Les régions où ce taux d’obésité est encore faible – Asie et Afrique – sont par-là protégées, à l’inverse, au Moyen-Orient, l’obésité pourrait contribuer à élever le tribut du Covid19[9].
Modulations nationales
La combinaison de ces facteurs génétiques, ou influencés génétiquement, rend compte d’une partie des différences de mortalité d’un pays à l’autre. Il s’agit surtout des variations de la létalité, reste à rendre compte des différences plutôt associées aux processus d’infection, sur lesquels s’appliquent les taux de létalité.
C’est cette partie inexpliquée par les facteurs génétiques pris en compte, que l’on considère maintenant. La variable dépendante utilisée ici ce sont les ‘résidus’ des taux de décès une fois défalquée la part expliquée par les facteurs génétiques dans le modèle hiérarchique[10]. Les taux cumulés d’infection sont, au sein des grandes régions du monde, caractérisés par des similitudes de contexte climatique et de densité des contacts entre les individus. Ils sont modulés d’un pays à l’autre par des différences sociales et comportementales et par des fragilités physiques indépendantes des facteurs génétiques pris en compte. On a estimé deux équations selon que l’obésité a été utilisée comme proxy-génétique ou ne l’a pas été.
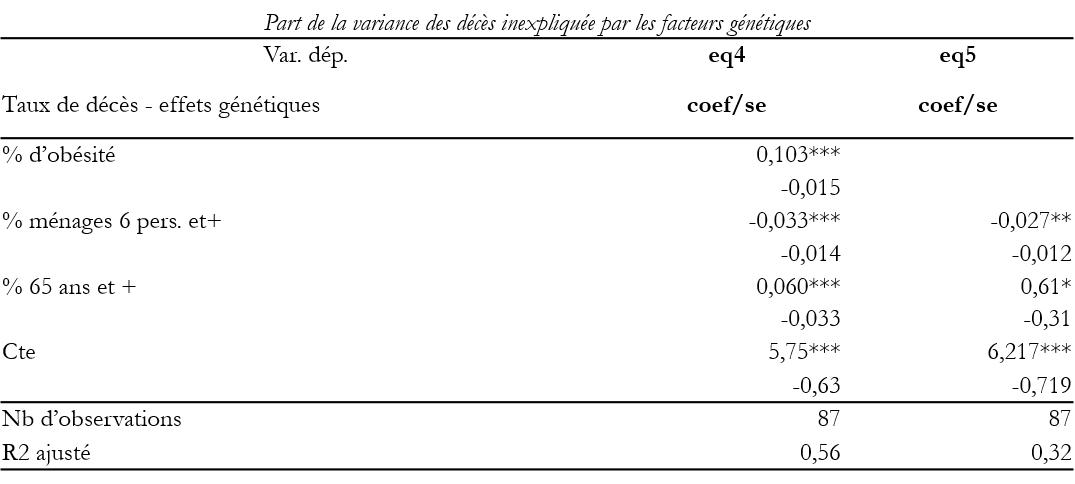
Note : le nombre de pays est réduit du fait des valeurs manquantes pour la taille des ménages.
Lorsqu’on ne la prend pas comme proxy génétique, l’obésité-pathologie élève significativement les taux de décès (eq4). Les pays comme la France ou l’Italie sont cette fois favorisés (la proportion d’obèses y est faible), par rapport à l’Irlande ou à la Grèce où les personnes en surpoids sont nombreuses. Outre l’obésité qui, à dispositions génétiques égales, accroit le taux des décès, deux autres variables sont importantes : la structure d’âge et la taille des unités domestiques. Un pourcentage élevé de familles de six personnes ou plus tend à augmenter le tribut payé au Covid19 en élevant les infections.
Ainsi, au 15 décembre 2020, pour un taux de mortalité européen autour de 700 par million (le taux européen des décès une fois contrôlé les facteurs génétiques), la France et l’Italie d’un côté avec 1000 décès par million sont à -300 (700 -1000), l’Allemagne et le Danemark de l’autre avec 400 décès par million sont à +300 (700 – 400). Les coefficients s’interprètent alors aisément : l’Italie et la France ont plus de familles larges, un coefficient négatif appliqué à ce surcroit rend compte du -300, et ce même coefficient négatif appliqué au ‘déficit’ de grands ménages des Allemands et Danois rend compte du +300 (voir graphique ci-dessous).
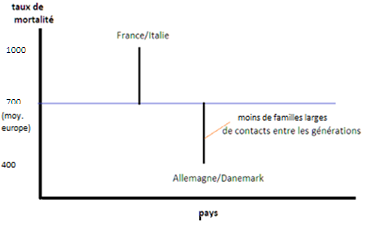 Réciproquement la France a, régionalement ‘parlant’, une population légèrement plus jeune, un ‘faible’ taux de plus de 65 ans, qui réduit son taux de décès (car s’agissant des infections, le déficit de personnes âgées, c’est moins de contacts).
Réciproquement la France a, régionalement ‘parlant’, une population légèrement plus jeune, un ‘faible’ taux de plus de 65 ans, qui réduit son taux de décès (car s’agissant des infections, le déficit de personnes âgées, c’est moins de contacts).
Cette analyse, dissociant le rôle des facteurs qui régissent la létalité de celui des facteurs favorisant les contaminations, s’articule sur l’explication biomédicale. Les taux de létalité sont en quelque sorte des « coefficients de transformation » en décès des stocks de contaminations spécifiques aux grandes régions du monde. Ainsi la ‘faible’ mortalité en Asie en 2020 s’expliquerait largement par les dispositions génétiques prévalentes, notamment la fréquence du génotype ACE-II, qui permettent de mieux résister aux dérèglements hypertensifs et à l’emballement inflammatoire. Par ailleurs l’analyse suggère que les différences de taux contamination, sur lesquelles s’appliquent les taux de létalité, dépendent notamment de la taille des ménages, de la part des personnes âgées et encore de l’obésité, qui favorise une expression accrue du récepteur ACE2 dans les tissus adipeux.
*
Naturellement cette analyse reste extrêmement schématique et parle du passé, elle porte sur la souche du Covid19 avant que l’effet des mutations récentes ne soit sensible. Les nouvelles souches étant, à densité de contacts égale, plus contagieuses, il y a une nouvelle combinaison entre le pouvoir d’infection biologique du virus et la densité des contacts.
Si cette analyse a une portée politique, c’est de souligner la fragilité des pays occidentaux, la menace qui pèse sur l’Afrique à cause des dispositions immunitaires et d’un système de santé plus précaire, ce qui nous oblige en termes d’accès aux vaccins et d’antiviraux.
Mots-clés : Covid19 – enzyme ACE2 – obésité – démographie
Cet article a été initialement publié le 1er février 2021.
* L’auteur remercie Gérard Bouvier, A Minczeles et Eric Tazé-Bernard pour leurs remarques sur ce texte.
Références
Delanghe J., Speeckaert M., De Buyzere M. (2020) ACE polymorphism and COVID-19 outcome. Endocrine 70:13–14.https://doi.org/10.1007/s12020-020-02454-7
Devaux Ch., Rolain J-M., Raoult D. (2020) ACE2 receptor polymorphism: Susceptibility to SARS-CoV-2, hypertension, multi-organ failure. Science Direct, May.
Groot D. & al. (2020) Arteriosclerosis, Thrombosis, and Vascular constriction. Biology 40: https://doi.org/10.1161/ATVBAHA.119.313658.
Rigat B., Hubert Ch., Alhenc-Gelas F., Cambien F., Corvol P., Soubrie F. (1990) An Insertion/Deletion Polymorphism in the Angiotensin I-converting Enzyme Gene Accounting for Half the Variance of Serum Enzyme Levels. J. Clin. Invest. Vol. 86, October, 1343-1346
Sardon J.-P. (2020) De la longue histoire des épidémies au Covid-19, Les analyses de Population & Avenir, avril, 1-30.

*
[1] Mais s’avère assez impitoyable après. En effet pour les Occidentaux, l’élargissement de l’espérance de vie n’est pas dû à la réduction de la mortalité infantile mais au maintien en vie d’hommes et de femmes fragilisés certes mais qu’un confort matériel et une médecine moderne protègent à court terme.
[2] L’obésité est un mélange de maladie souffrance et de « maladie » comportement. L’obésité n’est pas communicable au sens médical – l’emploi du mot épidémie pour la diffusion de l’obésité ne peut être que métaphorique.
[3] Ni les mêmes enjeux en termes de politique de santé.
[4] Selon l’acronyme anglais.
[5] Cette voie a été empruntée par Delanghe et al. 2020, pour l’Europe, sans dissocier toutefois infection et létalité.
[6] On pourrait, si l’information était aisément accessible, prendre en compte d’autres polymorphismes, notamment ceux qui affectent l’expression de la protéase trans-membrane TMPRSS2, qui contribue à l’accrochage du virus sur les cellules pulmonaires. Comme l’expression de TMPRSS2 est étroitement corrélée à celle d’ACE2, elle figure implicitement dans ce modèle.
[7] Les valeurs des taux nationaux d’infection peuvent s’écrire multiplicativement :
ou additivement :
. Les quantités
sont spécifiques à chacune de ces grandes régions (l’indice
ne prend que six valeurs). De même pour la létalité
soit en log :
. Et l’on peut regrouper
et
en un résidu unique
.
[8] On l’a vérifié dans chaque région prise séparément.
[9] Mais il faut être prudent car on raisonne ici sur l’obésité comme si c’était la mesure d’une disposition génétique.
[10] C’est-à-dire la valeur moyenne régionale du taux de décès une fois défalquée la part des facteurs génétiques.
- A quoi sert la toxicomanie ? Retour sur les drogues addictives - 28 septembre 2023
- Infectants & vulnérables : les ambiguïtés du confinement - 7 février 2022
- Le Covid19, les gènes et le comportement* - 9 août 2021

Article très intéressant. Les équations n’apparaissent pas (eq1, eq2, …, eq5). On devine mais ce serait plus clair avec. Est-il possible d’avoir accès aux données ?
Veuillez d’abord m’excuser je n’avais pas pris connaissance de votre demande. Les données utilisées sont maintenant datées mais je peux si vous le souhaitez vous envoyer le fichier stata avec lequel j’ai travaillé et les commandes des régressions. Dans ce cas, il me faudra le nettoyer car c’est un fichier de travail que j’ai laissé en l’état.
La diffusion du variant delta est en train de changer la donne. Va-t-elle complètement bouleverser cette hiérachie ?
Bien à vous
Hugues lagrange
Papier très intéressant qui permet, de différencier les contextes de santé (rôle de l’équipement génétique des peuples, des comorbidités existantes, des groupes sanguins, etc.), dont certains aspects ont déjà grosso modo fait l’objet de communication, mais aussi géo-sociaux, ce qui est plus rare, en revanche, par une modélisation éclairée des modulations nationales. Je pense qu’un executive summary de ce papier serait utile et mériterait une diffusion élargie…
Bravo et merci pour cet éclairage passionnant.
Tellement rare de lire des choses intelligentes sur le Covid !